ビジョン
生命(いのち)の理(ことわり)の全貌解明
〜基本単位「細胞」の動作原理の構成的理解を通じて〜
60兆個とも言われるヒトの細胞は、決して常に同じ状態にあるわけではありません。個々の細胞はたえず外界の環境変化に応答しており、それらが互いに協調して生理機能を発揮することで、1個の生体としての恒常性が保たれています(動的恒常性の維持)。その仕組みを、少しくわしくお話ししましょう。
細胞は、そのひとつひとつが、脂質二重層にさまざまな糖タンパク質が埋められた「細胞膜」で囲まれています。温度変化や外来物質の接触など、外部からの刺激を察知すると、最初に細胞膜がナノレベル(1ナノメートルは1ミリメートルの1/1,000,000のサイズ)の変化を起こします。これを私たちは「細胞膜ナノ動態」と呼んでいます。そして、それが引き金となって、細胞内では刺激に応じた一連の分子反応が起こります。これが「細胞内シグナル伝達」です。
細胞内シグナル伝達が精確に制御されることが、細胞、ひいては生体が正しい生理機能を発現するうえで重要です。もっと端的にいえば、シグナル伝達は生命現象の根幹をなす、とも表現できるでしょう。
さらに、細胞の中には、それぞれ一定の機能をもった「オルガネラ(小器官)」が存在し、オルガネラもまた膜で囲まれた構造をしています。細胞内シグナル伝達によって、オルガネラの膜ナノ動態も変化し、さらなるシグナル伝達を行うことを私たちは見出しています。
細胞膜とオルガネラ、両方の「膜ナノ動態」については、まだまだ分かっていないことがたくさんあります。細胞内シグナル伝達も同様です。 私たちは、これらの制御のプロセスを「バイオイメージング技術」を武器に可視化、観察し、得られた結果を考究します。そこから、生命のしくみについて包括的な理解を深めます。
さあ、見てみよう、生命の営みを。合言葉は”Seeing is believing”です。
人材育成方針
知の創造とそれを担う人材育成の場の提供
私たちの研究室から、教科書の1ページが書き換えるような成果が発信できれば、これほど嬉しいことはありません。とはいえ、自分たちだけでできることはそれほど多くはないのも現実で、後進の科学者を育てることは大事な責務と考えています。研究室のメンバーひとりひとりの成長の実感と夢を実現する場を、研究活動を通じて形成したいと考えています。特に、現在やその後のキャリアにおいて、プロフェッショナルかつグローバルな人物たる人材の育成に貢献したいと思っています。
研究室への参加(希望)者には、「自分が学びたいことや求めたいもの」に加えて、「自分が研究室に貢献できるもの」の両方を探して欲しいです。研究室に入って自分自身に得るものがなければ意味が無いのはもちろんですが、逆に「大学だから学ぶ場所」としか考えていない人には、研究者として(あるいはその後他の職種についても)大きな成長は見込めないと思います。両方を見つけそれらを極めた人がいい仕事をし、自分自身も成長を実感しながら育っていってくれるものだと確信していますし、そのような場を提供したいと思っています。
用語集
当研究室の研究を理解する助けになる、あるいはよく使われる単語のとその解説をまとめました。
細胞内シグナル伝達
細胞シグナル伝達は一般に、細胞表面の受容体タンパク質にリガンド物質が結合することで引き起こされます。これを引き金に、細胞内で連続的に分子間相互作用が起こり、シグナルが秩序正しく増幅・伝達されていきます。その結果、細胞内外に存在する特異的タンパク質の翻訳後修飾や構造変化などが生じ、そのタンパク質の活性や機能が変化します。つまり、細胞内シグナル伝達が秩序正しく時間的・空間的に厳密に制御されることで、遺伝子発現制御や細胞形態の変化などの表現形が規定され、最終的には生体反応が制御されているのです。
蛍光タンパク質
緑色蛍光タンパク質(green fluorescent protein, GFP)は、オワンクラゲの発光器官から単離された「光る」タンパク質です。1992年にそのcDNAがクローニングされて以来、各種細胞に蛍光物質を導入できるようになりました。細胞内のダイナミックなタンパク質動態や環境変化の可視化に汎用されています。 なお、このタンパク質の発見と応用によって、下村脩博士は2008年、日本人で5人目となるノーベル化学賞を受賞されました。
FRET
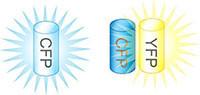
フェルスターの共鳴エネルギー移動(Förster resonance energy transfer, FRET)は、二つの蛍光分子間でエネルギーが移動する現象です。GFPの変異体を用いる場合にはシアン色の変異体(あるいは単にシアン色蛍光タンパク質cyan fluorescent protein, CFP)と黄色変異体(YFP)がよく用いられ、CFPとYFPが近接した場合にのみCFPからYFPへのFRETが生じます(図1)。生きた細胞内でタンパク質間相互作用やタンパク質の構造変化や活性化を、高感度かつ定量的に測定することが可能です。
図1 FRETの原理 CFPは通常440 nmの励起光で480 nmの蛍光を発する。ここにエネルギー受容体であるYFPが近接していると、エネルギー遷移が生じ、同じ440 nmの励起光に対してYFPの蛍光(530 nm)が認められる。480と530 nmの蛍光強度比を指標にCFPとYFPの距離を知ることができる。
BiFC
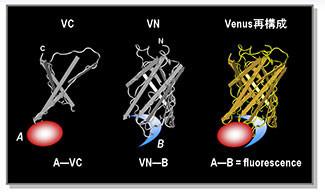
EGFPは240個ほどのアミノ酸からり、図2の左のようなベータバレル構造をしています。それを適当な位置で切断すると各々のタンパク質は光を発しません(図2左)。しかし両者が結合した時は完全な構造が形成され蛍光を発します(図2右)。これが、蛍光タンパク質再構成法(bimolecular fluorescence complementation, BiFC)です。 相互作用を調べたいタンパク質にそれぞれを結合することでその結合を観察することができます。結合の増加が単に蛍光強度の増強で検出できる単純さがあり、GFPを用いれば通常の蛍光顕微鏡に備え付けのFITCフィルターだけで観察可能です。また、相互作用が単色で検出可能な点は魅力的で、複数の分子間相互作用の同時観察も容易に行えます。
図2 BiFCによる分子間相互作用の検出原理 蛍光タンパク質YFP(Venus)をN末とC末側に分断すると(図では172-173アミノ酸)、蛍光は発しない。それぞれに結合が期待される二つのタンパク質AとBを融合する。AとBの結合がVenusの構造の再構成を起こし蛍光を発するため、タンパク質間相互作用が蛍光強度の増加として観察される。
エンドサイトーシス
エンドサイトーシスは細胞外の物質を細胞内に取り込む仕組みです。エンドソーム膜の構成成分やその形成機構によって、クラスリン依存性エンドサイトーシス(受容体型エンドサイトーシスと呼ばれることもあります)、カベオラ型エンドサイトーシス、クラスリン非依存性エンドサイトーシス等に分類されます。クラスリン依存性エンドサイトーシスは、主にリガンドと結合した受容体が細胞内に取り込まれるための機構です。取り込まれた小胞はクラスリンが脱被覆化した後に小胞同士が融合して初期エンドソームとなります。その後、一部は後期エンドソーム、リソソームへと進む分解経路、一部はリサイクリングエンドソームへと進む再利用経路へと運命を分かちます。カベオラ型エンドサイトーシスは、細胞膜内葉のコレステロールとの結合を介して自己会合したカベオリンがくぼみ構造(カベオラ)を形成します。クラスリン非依存性エンドサイトーシスは、クラスリンやカベオラ型エンドサイトーシスとは異なり被覆小胞を形成せずに物質を取り込みます。マクロピノサイトーシスやファゴサイトーシス等がこの様式に含まれます。
シグナル伝達とエンドサイトーシスのイメージング
Ras-PI3Kシグナルによるエンドサイトーシス制御機構
低分子量Gタンパク質であるRasは、下流で働く複数の標的因子を「いつ、どこで」活性化させるか巧妙に制御することで、シグナル伝達において多彩な役割を担っています。生きた細胞におけるRasとその標的因子が形成する複合体の挙動をBiFC法で可視化したところ、Rasとphosphoinositide 3-kinase(PI3K)の複合体は、他の標的因子とは異なり細胞膜だけでなくエンドゾームにも局在していました(図1)。また、Ras-PI3K複合体が細胞膜からエンドゾームに移行し、エンドゾームから発信するシグナルが、クラスリン非依存性エンドサイトーシスの制御に重要なことも明らかとなりました。 本研究により、これまで細胞膜が主戦場であると考えられてきたRas-PI3Kシグナルにエンドゾームという新たな活躍の場を見出すことができました。この発見は、ダイナミックに変化するタンパク質相互作用を実際に見ることからスタートした成果であり、 “seeing is believing”をまさに体現した好例です。
図1 Ras-PI3K複合体はエンドゾームに局在する BiFC法を用いてRasと標的因子が形成する複合体を可視化した。Ras-PI3K複合体は細胞膜だけでなく、エンドゾームにも局在した。
【関連業績】
- Visualization of Ras-PI3K interaction in the endosome using BiFC. Tsutsumi K, Fujioka Y, Tsuda M, Kawaguchi H, & Ohba Y. Cell Signal. 21: 1672-1679, 2009
Ras-PI3Kシグナルとインフルエンザウイルスの宿主細胞取り込み機構
準備中
【関連業績】
- The Ras–PI3K Signaling Pathway Is Involved in Clathrin-Independent Endocytosis and the Internalization of Influenza Viruses. Fujioka. Y, Tsuda M, Hattori T, Sasaki J, Sasaki T, Miyazaki T & Ohba Y. PLoS ONE 6: e16324, 2011
- A peptide derived from phosphoinositide 3-kinase inhibits endocytosis and influenza virus infection. Fujioka Y, Satoh A, Horiuchi K, Fujioka M, Tsutsumi K, Sasaki J, Nepal P, Kashiwagi S, Paudel S, Nishide S, Nanbo A, Sasaki T, & Ohba Y. Cell Struct Funct 44: 61-74, 2019
Ca2+シグナルを介したインフルエンザウイルスの宿主細胞侵入機構
多くのウイルスは細胞に侵入する際に細胞が持つエンドサイトーシス機構を利用します。例えばインフルエンザはクラスリン依存性エンドサイトーシスで細胞に侵入すると言われていました。しかし、私たちの研究から、Ras-PI3Kシグナルの活性化を介して、クラスリン非依存性エンドサイトーシスでも侵入可能なことが証明されました。また、その際に細胞内カルシウム濃度の上昇を引き金に、Ras-PI3Kシグナルを活性化することが明らかとなりました(図2)。
図2 ウイルス感染による細胞内カルシウムイオン濃度の一過性上昇 培養細胞にカルシウムイオン濃度をモニターするFRETセンサーを発現させ、ウイルス感染後のカルシウム動態を生きた細胞で観察した。感染直後に、複数回の細胞内カルシウムイオン濃度の一過的上昇が起こった。
さらに解析を進めると、ウイルスが感染した時に生じるカルシウム濃度上昇をきっかけに、Ras-PI3Kシグナルのみならず様々なシグナルネットワークが発動し、種々のエンドサイトーシスが促進することが分かりました(図3)。 すなわち、インフルエンザウイルスは宿主細胞内カルシウム濃度など、細胞内シグナル伝達機構を乗っ取ることで、細胞内に侵入しやすい環境を作り出しているというモデルが考えられます。本研究のように、ウイルスを用いて細胞の機能を探求することにより、これまでは明らかではなかった細胞に潜むメカニズムの解明が加速するものと期待されます。
図3 カルシウムシグナルを介したインフルエンザウイルスの侵入機構 インフルエンザウイルスは細胞に吸着するとすぐさま、カルシウム濃度上昇→RhoA活性化→カルシウム濃度上昇というシグナルを発動させ、エンドサイトーシスを亢進することで効率的に細胞に侵入する。
さらに、インフルエンザウイルスが細胞内カルシウム濃度を上昇させるメカニズムを調べたところ、電位依存性カルシウムチャネルが鍵であることが解りました。電位依存性カルシウムチャネルの阻害薬であるカルシウムブロッカーはin vitroだけでなくマウスを用いたin vivoでの系やヒト細胞を用いたex vivoの実験系でも感染抑制効果を示しました。今後の抗インフルエンザ薬開発への展開が期待されます。
【関連業績】
- A Ca2+-dependent signalling circuit regulates influenza A virus internalisation and infection. Fujioka Y, Tsuda M, Nanbo A, Hattori T, Sasaki J, Sasaki T, Miyazaki T & Ohba Y. Nat. Commun. 4: 2763, 2013
- 北大によるプレスリリース記事
- Yahooニュース
- 北海道のニュース・気象情報、ネットワークニュース北海道(ともにNHK、11/14)
- A Sialylated Voltage-Dependent Ca2+ Channel Binds Hemagglutinin and Mediates Influenza A Virus Entry into Mammalian Cells. Fujioka Y, Nishide S, Ose T, Suzuki T, Kato I, Fukuhara H, Fujioka M, Horiuchi K, Satoh A, Nepal P, Kashiwagi S, Wang J, Horiguchi M, Sato Y, Paudel S, Nanbo A, Miyazaki T, Hasegawa H, Maenaka K, Ohba Y. Cell Host Microbe 23: 809-818, 2018
オルガネラダイナミクス
オルガネラマーカーライブラリの構築
様々なオルガネラを生きた細胞において可視化するためのマーカーを作製しております。現在作製済みのものとしては、核、細胞膜、アクチン、微小管、接着斑、ミトコンドリア、初期エンドゾーム、後期エンドゾーム、リサイクリングエンドゾーム、ゴルジ装置、小胞体です。それぞれのオルガネラに対して、Sirius(群青)、SECFP(シアン)、EGFP(緑)、Venus(黄)、tdTomato(赤)、mCherry(赤)、TFP650(近赤外)、iRFP713(近赤外)、Keima(青色励起で赤色蛍光)等の蛍光タンパク質が融合したコンストラクトを作製し、マーカーライブラリを構築しております。 この過程で私達は、ミトコンドリアマーカーやエンドソームマーカーに、フォールディングが早い(すなわち「明るい」)蛍光タンパク質を融合させると、本来の局在化が阻害され、細胞質や核に漏れることを見出しました。
サンプルリクエストはこちら
【関連業績】
- Folding latency of fluorescent proteins affects the mitochondrial localization of fusion proteins. Kashiwagi S, Fujioka Y, Satoh AO, Yoshida A, Fujioka M, Nepal P, Tsuzuki A, Aoki O, Paudel S, Sasajima H & Ohba Y. Cell Struct. Funct. 44: 183-194, 2019
- Localization of BCR-ABL to stress granules contributes to its oncogenic function. Kashiwagi S, Fujioka Y, Kondo T, Satoh AO, Yoshida A, Fujioka M, Sasajima H, Amano M, Teshima T & Ohba Y. Cell Struct. Funct. 44: 195-204, 2019
- Attenuation of ligand-induced activation of angiotensin II type 1 receptor signaling by the type 2 receptor via protein kinase C. Inuzuka T, Fujioka Y, Tsuda M, Fujioka M, Satoh AO, Horiuchi K, Nishide S, Nanbo A, Tanaka S & Ohba Y. Sci. Rep. 6: 21613, 2016
FRETバイオセンサーの臨床応用
〜光診断薬の開発と事業化〜
蛍光バイオイメージングは、生きた細胞内でタンパク質間相互作用やタンパク質の構造変化を、高感度かつ定量的に測定することが可能な技術です。私たちの研究室では、この特長を活かして、蛍光タンパク質のイメージングを臨床検査に応用することを目指しています。
慢性骨髄性白血病(chronic myeloid leukemia, CML)は、骨髄の造血幹細胞に異常染色体(フィラデルフィア染色体, Ph1)が形成され、白血病の原因タンパク質BCR-ABLが細胞内に出現し発症する血液のがんです。BCRーABLチロシンキナーゼに対する3種類の分子標的治療薬が標準治療に使われています。 しかし、患者さんごとにどの薬が有効なのか、実際に治療を始めてみるまでは分からないことが課題となっています。治療前から個々の患者さんに対して薬の有効性を判定したり、治療中に薬剤耐性細胞の有無を検出したりする技術があれば、はじめから効果的な治療を行うことができます。
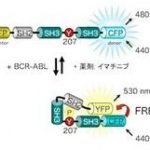
図1 BCR-ABL活性測定センサーPickles BCR-ABLの基質であるCrkLはリン酸化されると構造変化する。CrkLの両端にYFP(Yellow fluorescent protein, 黄色蛍光タンパク質)とCFP(Cyan fluorescent protein, 青色蛍光タンパク質)を付けることで、BCR-ABLの活性に応答してFRETが生じるセンサーの開発に成功した。
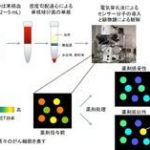
私たちはBCR-ABLの基質CrkLとFRETの原理を利用したバイオセンサー Pickles(Phosphorylation indicator of CrkL en substrate、図1)を開発しました。また、それを用いることで、実際に患者さんから採取したCML細胞がどのような薬剤反応性を示すかを一細胞レベルで解析することを可能にしました(図2)。
図2 Picklesによる薬効評価プロセス 患者さまから得た血球から、単核球分画を単離し、Picklesを導入する。24時間後にはセンサー分子の蛍光が観察可能であり,顕微鏡で一つ一つのFRET効率を測定できる。薬剤処理後にすべての細胞でBCR-ABLの活性が抑制(FRET低)されていれば薬剤が有効、抵抗性の場合にはFRETの高い細胞が残存する。
本技術を治療前のCML患者さんに用いることで、有効な分子標的治療薬を実際に予測できるようになりました。これにより、個々の患者さんにフィットした治療薬をあらかじめ選択できると考えられます。また本手法には「細胞を生きたまま解析する」という、これまでの検査にはない特長があります。つまり、薬剤耐性細胞のみを集めることも可能なことから、薬剤耐性獲得機構の解明へ発展させることも期待できます。 さらに、他のキナーゼ活性を測定する光診断薬を開発することで、理論的には分子標的治療薬を用いるすべてのがんに応用拡大が可能です。
本研究は、科学技術振興機構(JST)の「社会還元加速プログラム(SCORE)」(2019年度)、テルモ生命科学振興財団の「研究開発助成(開発助成)」、国立研究開発法人新エネルギー・産業技術総合開発機構(NEDO)の「研究開発型スタートアップ支援事業/NEDO Entrepreneurs Program(NEP)タイプB」(2021年度)、「研究開発型スタートアップ支援事業/シード期の研究開発型スタートアップに対する事業化支援(STS)」(2022年度)のご支援をいただき、一日も早く患者さまの手元に本技術が届くように、事業化を目指しています。
詳しくはHILO株式会社のページをご覧ください。
【関連業績・参考文献】
-
A novel FRET-based biosensor for the measurement of BCR-ABL activity and its response to drugs in living cells. Mizutani T, Kondo T, Darmanin S, Tsuda M, Tanaka S, Tobiume M, Asaka M, & Ohba Y*. Clin. Cancer Res. 16(15): 3964-3975, 2010
- Commentary on this paper: Clin. Cancer Res. 16(15): 3822-3824 (2010)
- AACR(米国がん学会)
- 北海道大学
- 日経プレスリリース(リンク切れ)
- ネットワークニュース北海道(NHK、7/29)
- 道新ニュース(テレビ北海道、7/31)
- 北海道新聞(7/30朝刊)
- 読売新聞(7/29朝刊)
- 毎日新聞(7/30朝刊)
- ロイター通信
- BTJ アカデミック 7/29のアクセスランキング1位!
- Improved FRET biosensor for the measurement of BCR-ABL activity in chronic myeloid leukemia cells. Horiguchi M, Fujioka M, Kondo T, Fujioka Y, Li X, Horiuchi K, Satoh A, Nepal P, Nishide S, Nanbo A, Teshima T, and Ohba Y*. Cell Struct Funct 42, 15-26, 2017
- Pre-treatment evaluation of FRET-based drug sensitivity test for patients with CML treated with dasatinib. Kondo T, et al, Cancer Sci. 109(7): 2256-2265, 2018
- Clinical efficacy and safety of first-line nilotinib therapy and evaluation of the clinical utility of the FRET-based drug sensitivity test. Kondo T, et al. Int. J. Hematol. 110(4): 482-489, 2019
- シグナル伝達研究2008-’09 ―疾患発症の分子メカニズムと実現化する分子標的薬開発―細胞内シグナル伝達の可視化とその創薬への応用 大場雄介、津田真寿美 実験医学 25(15)(増刊): 206-213 (2506-2513), 2008
- バイオイメージングの基礎と応用 津田真寿美、 大場雄介 細胞 41(11): 462-463, 2009
- Localization of BCR-ABL to stress granules contributes to its oncogenic function. Kashiwagi S, Fujioka Y, Kondo T, Satoh AO, Yoshida A, Fujioka M, Sasajima H, Amano M, Teshima T & Ohba Y. Cell Struct. Funct. 44: 195-204, 2019